ISE متر
ISE متر یا کیفیت سنج آب اسیدیته (pH)، اکسیژن محلول (DO)، پتانسیل اکسید کننده-کاهش (ORP) و عوامل مختلف دیگری را اندازه گیری می کند که به کاربر در درک کیفیت و ترکیب نمونه کمک می کند. کیفیت آب به دلایل واضح بسیاری ضروری است، اما در حفظ سلامت دستگاه نیز حیاتی است.
الکترود انتخابی یون (ISE) نوعی حسگر است که برای تعیین غلظت یون های خاص در یک محلول آبی با تبدیل فعالیت آن یون به یک پتانسیل الکتریکی که می تواند توسط یک ولت متر اندازه گیری شود، استفاده می شود. ISE یک عنصر مهم در تجزیه و تحلیل کیفیت آب است. بسته به الکترود، مترهای ISE قادر به شناسایی و اندازه گیری غلظت طیف گسترده ای از عناصر یا ترکیبات شیمیایی از جمله فلوراید، برومید، کادمیوم و گازهای موجود در محلول مانند آمونیاک، دی اکسید کربن و اکسید نیتروژن هستند.
استفاده از الکترودهای انتخابی یونی مزایای متعددی نسبت به سایر روشهای آنالیز مانند نورسنجی دارد. در مقایسه با سایر تکنیک های تحلیلی، الکترودهای انتخابی یونی ارزان، سریع، قابل حمل و آسان برای استفاده هستند. یک سیستم کامل شامل یک متر، پروب های مخصوص یون و مجموعه ای از محلول ها از جمله محلول های مرجع، تنظیم کننده های قدرت یونی و محلول های ذخیره سازی است. همه اینها معمولاً می توانند در یک کیت حمل آسان برای حمل و نقل جا شوند. الکترودهای حالت جامد با بدنه پلاستیکی یا الکترودهای پر شده با ژل قوی و بادوام هستند و آزمایش میتواند شامل پایین آوردن کاوشگر در دریاچه، رودخانه یا نمونههای دیگر باشد. مترهای ISE در کاربردهایی که نیاز به نظارت دائمی دارند عالی هستند.
این بدان معنا نیست که الکترودهای مخصوص یون محدودیتی ندارند. اگرچه با استفاده دقیق از آنها می توانند به سطوح دقت 2-3٪ دست یابند، آنها می توانند مستعد تداخل یون های دیگر در محلول باشند. علاوه بر این، مترهای ISE در طول یک سری اندازه گیری مستعد جابجایی هستند و همچنین ممکن است در معرض تغییرات قدرت یونی قرار گیرند که می تواند منجر به کاهش دقت شود مگر اینکه از تهویه کننده ها استفاده شود.
متر ISE یک انتخاب برجسته برای طیف گسترده ای از کاربردها از جمله نظارت بر آلودگی، کشاورزی، فرآوری مواد غذایی، تولید (برای مطالعه اثرات بر کیفیت آب)، آبکاری، آزمایشگاه های زیست پزشکی، آموزش و تحقیقات است.
فناوری اندازه گیری ISE
الکترودهای انتخابی یونی بر اساس اصل اندازهگیری پتانسیل الکتریکی یونهای خاص در محلول عمل میکنند، زیرا آنها از ناحیهای با غلظت بالا به ناحیهای با غلظت کم در یک غشای نفوذپذیر انتخابی حرکت میکنند.
متر ISE از دو الکترود تشکیل شده است، یک الکترود حسگر - که اغلب نیم سلول نامیده می شود - و یک الکترود مرجع. بسیار رایج است که الکترودهای حسگر و مرجع در یک الکترود ترکیبی واحد ترکیب شوند. الکترود مرجع با یک الکترولیت با مقدار مشخصی پر می شود که فعالیت یونی آن را ثابت نگه می دارد.
الکترود حسگر شامل یک غشای تخصصی است که فقط به یون های خاص اجازه عبور می دهد. به عنوان مثال، الکترود حسگر یک pH متر فقط به یون های هیدروژن اجازه عبور می دهد. پس از غوطه ور شدن در محلول، یون های انتخاب شده از غشا عبور می کنند تا هر دو طرف غشاء به تعادل برسند. غلظت یون هایی که از غشا عبور کرده اند با ثابت موجود در الکترود مرجع مقایسه می شود. تفاوت بین الکترود حسگر و الکترود مرجع به سیگنال میلی آمپر تبدیل می شود. بر اساس معادله نرنست، گرادیان غلظت متناسب با گرادیان الکتریکی است.
اشاره به "غلظت یونی" کمی اشتباه است زیرا ISE ها فعالیت یونی را اندازه گیری می کنند نه غلظت. فعالیت یونی به قدرت یونی بستگی دارد. اگر قدرت یونی بالا باشد، غلظت متناسب با فعالیت است. تنظیم کننده های قدرت یونی برای افزایش استحکام محلول های کم فعالیت یونی استفاده می شود که باعث می شود نتایج آزمایش غلظت آینه بهتری داشته باشد.
الکترودهای انتخابی یونی در انواع مختلفی از سبکها در دسترس هستند و هر سازنده عناصر ساخت یا ترکیب خاص خود را دارد. با این حال، ویژگی های خاصی در همه ISE ها وجود دارد. همه لولههای استوانهای هستند که معمولاً از پلاستیک ساخته میشوند. غشای انتخابی یونی در یک انتها ثابت می شود به طوری که محلول خارجی فقط می تواند با سطح بیرونی تماس پیدا کند و سر دیگر با اتصال به دستگاه اندازه گیری میلی ولت نصب شده است. اتصال داخلی با استفاده از یک الکترولیت مایع یا ژل یا یک سیستم حالت جامد کامل می شود.
انواع ISE متر
طیف وسیعی از انواع ISE گسترده است و نحوه عملکرد آنها بسیار پیچیده است. با این حال، اکثر ISE ها یکی از سبک های زیر هستند:
الکترودهای شیشه ای
الکترودهای شیشه ای ISE دارای یک غشای شیشه ای دوپ شده هستند که به یک یون خاص حساس است. الکترودهای شیشه ای که معمولاً برای اندازه گیری pH استفاده می شوند، می توانند برای استفاده با یون های دیگر از جمله لیتیوم، سدیم، آمونیوم و غیره نیز فرموله شوند.
الکترودهای حالت جامد
الکترودهای حالت جامد را می توان هم به صورت نیمه سلولی و هم به صورت الکترودهای ترکیبی از جمله الکترود مرجع یافت. این الکترودها دارای یک سطح حسگر جامد هستند که از هالیدهای نقره فشرده یا مواد کریستالی جامد ساخته شده است.
الکترودهای غشایی مایع
الکترودهای غشایی مایع را می توان هم به صورت نیمه سلولی و هم به صورت الکترودهای ترکیبی از جمله الکترود مرجع یافت. سطوح حسگر این الکترودها از یک پلیم همگن تشکیل شده است
ماتریس r حاوی مبدلهای یون آلی انتخابی برای یون تعیینشده. این حسگرها دارای ماژول های غشایی هستند که به راحتی قابل تعویض هستند و برای اندازه گیری نیترات، پتاسیم و کلسیم در دسترس هستند.
روشهای تجزیه و تحلیل ISE
ISE را می توان از طریق سه روش مختلف تجزیه و تحلیل کرد. مراحل واقعی بیش از حد مهم نیستند زیرا تا حدودی بسته به سازنده متفاوت است و هر متر در طول آزمایش شما را در این فرآیند راهنمایی می کند.
پتانسیومتری مستقیم
پتانسیومتری مستقیم ساده ترین و پرکاربردترین روش استفاده از ISEها است. این روش زمانی بسیار موثر است که دسته های بزرگی از نمونه ها که طیف وسیعی از غلظت ها را پوشش می دهند باید اندازه گیری شوند. با استفاده از پتانسیومتری مستقیم، این کار را می توان بدون نیاز به تغییر دامنه، کالیبراسیون مجدد یا انجام هر گونه محاسبات پیچیده انجام داد.
پتانسیومتری مستقیم شامل کالیبره کردن ابزار با دو یا چند استاندارد و استفاده از یک تنظیم کننده قدرت یونی برای نمونه و استاندارد است. فراتر از آن، به سادگی پاسخ الکترود به نمونه را اندازه گیری می کند و غلظت را مستقیماً از نمودار کالیبراسیون یا نمایشگر متر می خواند.
بسته به کاربرد، پتانسیومتری مستقیم می تواند نتایج قابل قبولی را با آویزان کردن الکترودها در رودخانه یا حوضچه یا خروجی پساب بدون نیاز به بازگرداندن نمونه به آزمایشگاه، به دست آورد.
روش های افزایشی
روشهای افزایشی چهار تکنیک مفید برای تعیین سریع غلظت یون در نمونههای دارای ترکیبات متغیر یا غلیظ هستند. چهار تکنیک: جمع شناخته شده، تفریق شناخته شده، جمع آنالیت، و تفریق آنالیت، همگی شامل افزودن یک استاندارد به نمونه یا یک نمونه به استاندارد هستند. سپس ISE غلظت یون نمونه نمونه آزمایشی را محاسبه می کند.
روشهای اندازهگیری افزایشی دارای مزایای ذاتی نسبت به پتانسیومتری مستقیم هستند. به عنوان مثال، در طول فرآیند آزمایش، الکترودها در محلول آزمایش غوطه ور می مانند. این از تغییر پتانسیل اتصال مایع الکترود مرجع جلوگیری می کند، که می تواند چندین میلی ولت در هنگام انتقال از یک محلول به محلول دیگر متفاوت باشد. آلودگی متقاطع بین نمونه ها نیز از بین می رود.
کالیبراسیون و اندازهگیری نمونه هر دو اساساً در یک زمان و در یک محلول انجام میشوند تا قدرت یونی، خطاهای ناشی از ویسکوزیته و اختلاف دما بین استاندارد و نمونه قابل توجه نباشد و خطاهای بالقوه ناشی از این شرایط کاهش یابد.
تیتراسیون پتانسیومتری
تیتراسیون عبارت است از افزودن آهسته یک محلول با غلظت شناخته شده (به نام تیتران) به حجم شناخته شده محلول دیگری با غلظت نامعلوم تا زمانی که واکنش به خنثی شدن برسد. این یک تکنیک برای تعیین غلظت یک محلول ناشناخته است و می تواند برای افزایش دقت اندازه گیری ISE استفاده شود.
تیتراسیون همچنین می تواند برای گسترش دامنه یون های قابل اندازه گیری توسط ISE ها استفاده شود که با روش های دیگر مانند پتانسیومتری مستقیم قابل اندازه گیری نیست. همچنین در هنگام کار با مواد ناپایدار یا سمی ابزار ارزشمندی است. در این موارد، یک محلول خطرناک یا غیرقابل اندازه گیری با یک تیترانت مخلوط می شود که محلول را ایمن یا قابل اندازه گیری می کند.
مراقبت و نگهداری از ISEs
ماهیت ISE ها ایجاب می کند که با کمی دقت به کار گرفته شوند. بسته به نوع الکترود، سطح غشاء ممکن است ظریف باشد و برای جلوگیری از آسیب باید با احتیاط برخورد کرد. پس از استفاده گسترده، غشاها می توانند با باقیمانده پوشیده شوند یا با خراش های ریز پوشانده شوند که بر عملکرد الکترود تأثیر منفی می گذارد.
پس از استفاده، الکترود باید شسته شود و اجازه داده شود تا خشک شود. برای نگهداری طولانی مدت باید از یک کلاه محافظ برای محافظت از غشا استفاده شود. راه حل های تمیز کننده ای در دسترس هستند که می توانند رسوبات ایجاد شده را حذف کنند. بسته به ISE، الکترود مرجع ممکن است شامل یک الکترولیت باشد که نیاز به پر کردن دوره ای دارد.
تمام الکترودهای شیشه ای دارای یک لامپ هستند که باید هیدراته نگه داشته شوند و یک اتصال مرجع که باید مرطوب نگه داشته شود تا از نشت بیش از حد محلول الکترولیت داخلی از محل اتصال مرجع جلوگیری شود. توصیه می شود که الکترودها را در محلول ذخیره سازی بین استفاده نگهداری کنید.











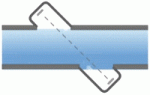 فلومتر التراسونیک
فلومتر التراسونیک فلومتر مغناطیسی
فلومتر مغناطیسی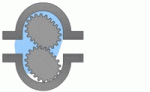 فلومتر مکانیکی
فلومتر مکانیکی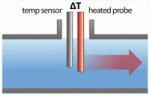 فلومتر جرمی حرارتی
فلومتر جرمی حرارتی فلومتر جرمی کوریولیس
فلومتر جرمی کوریولیس فلومتر توربین
فلومتر توربین فلومتر ورتکس
فلومتر ورتکس روتامتر
روتامتر دبی سنج پدالی
دبی سنج پدالی